培訓服務:內外兼修,審行致遠
聚焦內審員與外審員協同培養,打造全方位審核人才梯隊。課程專為培育復合型審核人才設計,課程深度融合ISO管理體系核心標準與行業最新合規要求,系統提升學員的條款解讀、證據溯源及風險預判能力。特邀國家級注冊審核專家授課,配套權威認證考試通道,助力學員快速獲得相關資質,同時也為企業可持續發展注入強效動能!

MDR臨床評價及技術文檔培訓
本課程是為期4天(2+2)的專業培訓,課程將深入解析歐洲醫療器械法規(MDR)框架下的臨床評價與技術文檔的核心要求。
臨床評價模塊,課程將系統闡述這一確保醫療器械安全與性能的關鍵流程。臨床評價作為預先規劃的系統化評估過程,旨在驗證醫療器械對MDR的合規性,并持續證明其風險收益比的可接受性。作為MDR要求的重要技術文件,臨床評價報告在CE認證過程中具有決定性作用。本模塊課程將深度解讀MDR臨床評價條款,結合典型案例,重點剖析臨床數據收集方法與MDR臨床評價的評審要點。
技術文檔模塊,課程將全面解析MDR 2017/745法規下的技術文檔編制要求。通過本模塊學習,您將掌握技術文檔的詳細編寫規范,準確識別現有文檔與MDR要求的差距,并制定切實可行的改進方案,確保技術文檔的完整性和合規性。本模塊課程將依據MDR最新要求進行重點講解與指導。
本課程采用"理論講解+案例分析+實操指導"的教學模式,旨在幫助學員全面提升MDR合規能力,為醫療器械產品順利通過CE認證奠定堅實基礎。
課程對象
本課程適用于醫療器械生產企業負責法規注冊、研發、臨床、售后監督、不良事件報告和質量管理體系的相關人員。
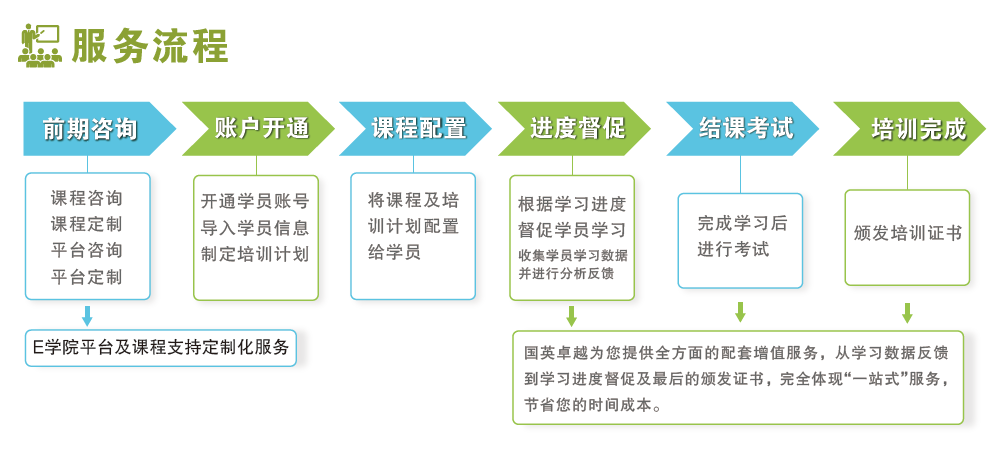
報名流程
課程大綱(Day 1-2)
主題:歐盟MDR臨床評價深度解析與實踐
模塊一:臨床評價基礎與框架
臨床評價概述:定義、目標與重要性
臨床評價在醫療器械生命周期中的關鍵作用
臨床證據的核心價值及其在MDR合規中的意義
模塊二:臨床評價流程與實施
臨床評價的觸發條件與實施時機
利益相關者角色與職責:制造商、公告機構、臨床專家等
等同產品的使用原則與限制
模塊三:臨床數據管理
臨床數據的類型與獲取途徑
數據收集、分析與評估方法 文獻回顧流程:數據庫選擇、檢索策略設計與關鍵詞優化
數據審閱與問題定義:如何構建高效的文獻檢索框架
模塊四:臨床評估計劃與報告(CEP/CER)
臨床評估計劃(CEP)的制定與關鍵要素
臨床評估報告(CER)的結構與內容要求
CER編寫流程與責任分工
模塊五:SOTA與風險效益評估
最新技術水平(SOTA)的定義與應用
性能與安全性分析
風險-效益評估方法與實踐
模塊六:常見問題與案例分析
臨床評價中的常見錯誤與規避策略
典型案例解析與經驗分享
課程大綱(Day 3-4)
主題:歐盟MDR技術文檔編寫與審查實務
模塊一:MDR技術文檔框架與審查流程
MDR技術文檔的結構與核心要求
文檔審查流程:形式審查與內容審查
模塊二:技術文檔核心要素解析
通用安全與性能要求(GSPR)文件編寫與審查
器械描述文件的關鍵內容與合規要點
制造商提供信息的規范與審查標準
模塊三:產品設計與制造文檔
產品設計文件的合規性要求
制造過程文件的編制與審查
持續改進管理體系的構建與實施
模塊四:風險管理與臨床前測試文檔
風險管理文檔的編寫與審查要點
臨床前安全性能測試報告的合規性要求
生物相容性研究資料的準備與審查
模塊五:專項研究資料審查
可用性研究資料的編寫與審查
滅菌確認資料的合規性要求
包裝運輸驗證資料的準備與審查
老化試驗資料的要求與審查要點



 京公網安備 11010202009534號
京公網安備 11010202009534號